|
中国苏州和美国马里兰州罗克维尔市2021年3月31日 /新闻稿网 - Xinwengao.com/ — 致力于在肿瘤、乙肝及与衰老相关疾病等治疗领域开发创新药物的处于临床阶段的研发企业 — 亚盛医药(6855.HK)今日发布2020年度业绩。在全球新冠疫情的严峻挑战之下,公司仍保持快速发展。报告期内,公司在临床开发、对外合作、专利布局等方面均获得较大进展,特别是递交了公司首个新药上市申请(NDA),并获纳入CDE优先审评,迎来即将从研发迈向生产的重要里程碑。
坚守全球创新定位,临床开发快速推进
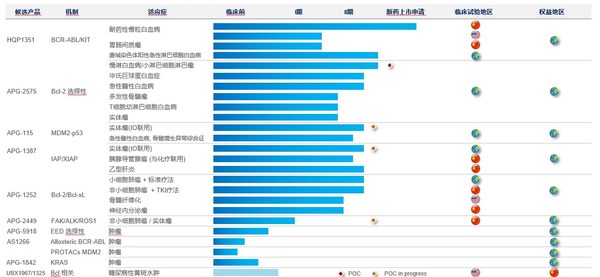
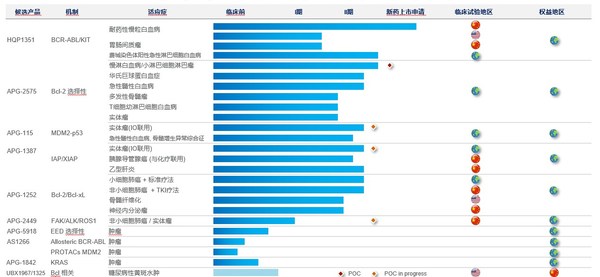
公司2020年全年研发支出为人民币5.65亿元,较去年同期增长21.7%,创新投入持续加码。截至2020年12月31日,亚盛医药已构建包括八个进入临床阶段、四个处于临床前阶段的小分子在研新药的丰富管线。公司产品管线主要专注细胞凋亡路径关键蛋白的抑制剂,通过抑制Bcl-2/Bcl-xL、IAP、MDM2-p53 等,重启肿瘤细胞的凋亡程序;以及新一代针对癌症治疗中出现的激酶突变体的抑制剂等。值得一提的是,报告期内公司通过对外合作获得一项基于蛋白降解靶向嵌合体(PROTACs)技术开发的MDM2蛋白降解剂的全球独家权益,进一步扩充产品布局。
报告期内亚盛医药在研产品取得重大进展,临床开发快速推进。目前公司在中国、美国及澳大利亚有超过40项I期或II期临床试验正在进行中。特别是公司的重要细胞凋亡品种APG-2575,作为首个在中国进入临床阶段的、本土研发的Bcl-2选择性抑制剂,正在全球范围内开展涉及多个血液肿瘤适应症的13项临床研究,并在报告期内宣告达到临床概念验证(POC):针对复发/难治慢性淋巴细胞白血病(r/r CLL)的临床研究已入组50多位患者,初步临床研究结果显示,在可评估患者中的客观缓解率(ORR)超过70%,展示了良好的治疗潜力。
亚盛医药始终坚持全球创新定位,瞄准全球市场。尤其值得一提的是,截至2021年3月31日,亚盛医药共有包括Bcl-2抑制剂APG-2575、第三代BCR-ABL抑制剂HQP1351、原创双靶点Bcl-2/Bcl-xL抑制剂APG-1252及MDM2-p53抑制剂APG-115四个在研新药,共获得美国FDA授予的11项孤儿药资格以及1项审评快速通道资格,创下了中国药企历来之最,充分展现了公司的全球化创新与开发实力。
公司首个NDA获纳入优先审评,商业化全面启动
作为亚盛医药的核心产品,第三代BCR-ABL抑制剂HQP1351在报告期内迎来多项重大里程碑。2020年6月,基于两项关键性注册临床研究的结果,公司向国家药品监督管理局(NMPA)新药审评中心(CDE)递交HQP1351的新药上市申请(NDA),用于治疗伴有T315I突变的慢性髓性白血病(CML)慢性期和加速期患者。这是亚盛医药创立以来的第一个新药上市申请,也将有望成为国内首个上市的第三代BCR-ABL抑制剂。
随后,公司全资子公司广州顺健生物获得由广东省药品监督管理局颁发的药品上市许可人(MAH)《药品生产许可证》(B证),是该省颁发的第一个原创化药1类新药的MAH《药品生产许可证》,为HQP1351的上市申请与商业化生产打下坚实基础。2020年10月,HQP1351正式被CDE纳入优先审评,朝获批上市又迈进一步。2021年3月,HQP1351被CDE纳入突破性品种,临床价值再获认可。
报告期内,HQP1351还接连获得美国FDA授予的孤儿药资格和审评快速通道资格,国际化开发同步推进。在2020年的第62届美国血液学会(ASH)年会上,HQP1351的关键性II期临床研究数据以口头报告形式公布,这是HQP1351的临床进展从2018年起连续第三次入选ASH年会口头报告。
随着HQP1351上市进程的逼近,亚盛医药的商业化布局已全面开启。2020年12月,负责商业化的核心高管正式就职,开始组建在血液肿瘤领域具有丰富经验的市场、销售团队。同时,亚盛医药在产业化方面也在快速推进,位于苏州在建的全球总部、研发中心及产业基地已完成结构封顶,或将在年内启用。
积极探索外延机遇,达成多项国际合作
研发实力雄劲的亚盛医药在保持内生式发展的同时,积极探索外延机遇,旨在通过全球合作网络,以获取更多候选药物和临床资源,从而推进产品研发。报告期内,公司与国家血液系统疾病临床医学研究中心达成战略合作,加码血液肿瘤领域的研究及临床开发。此外,公司通过与密歇根大学合作,开始涉足备受行业关注的PROTACs领域的研发,临床前候选药物取得新突破。
同时,公司亦积极与生物技术及医药公司建立全球合作关系。报告期内,亚盛医药相继与阿斯利康血液研发卓越中心Acerta制药、默沙东(MSD)达成全球临床研究合作,探索多个疾病领域的联合治疗。2020年12月,公司全球战略伙伴UNITY抗衰老领域药物UBX1325顺利进入临床,公司因此获得开发的里程碑付款,充分彰显了国际认可。
构筑知识产权护城河,巩固行业领先地位
作为立足中国,放眼全球的原创新药研发企业,全球知识产权与专利的布局对公司业务发展至关重要。报告期内,亚盛医药在全球拥有110项授权专利及450余项专利申请,其中约90项专利已在海外授权。
亚盛医药董事长、CEO杨大俊博士表示:“在全球新冠疫情的挑战下,亚盛仍在2020年获得多项里程碑进展,‘全球创新’的战略效应成果初显。我们递交了在中国的首个新药上市申请,并被纳入优先审评,这是非常重要的里程碑,意味着亚盛医药将从一个研发型企业真正成长为有产品上市的企业;细胞凋亡管线重要品种Bcl-2抑制剂APG-2575获得初步临床概念验证数据,进一步呈现了治疗潜力;首次在欧洲开展临床试验;与阿斯利康血液研发卓越中心、默沙东分别达成全球临床合作,全球合作再进一城;此外,我们还被纳入港股通,进一步扩大了投资者基础。未来,作为一家聚焦原创新药的企业,我们将坚持全球创新的策略,坚守“解决中国乃至全球患者尚未满足的临床需求”的使命,加快临床开发的速度,让安全有效的创新药物尽快上市,早日惠及全球患者,同时也为股东创造长期价值。”
关于亚盛医药
亚盛医药是一家立足中国、面向全球的处于临床开发阶段的原创新药研发企业,致力于在肿瘤、乙肝及与衰老相关的疾病等治疗领域开发创新药物。2019年10月28日,亚盛医药在香港联交所主板挂牌上市,股票代码:6855.HK。
亚盛医药拥有自主构建的蛋白-蛋白相互作用靶向药物设计平台,处于细胞凋亡通路新药研发的全球最前沿。公司已建立拥有8个已进入临床开发阶段的1类小分子新药产品管线,包括抑制Bcl-2、IAP 或 MDM2-p53 等细胞凋亡路径关键蛋白的抑制剂;新一代针对癌症治疗中出现的激酶突变体的抑制剂等,为全球唯一在细胞凋亡路径关键蛋白领域均有临床开发品种的创新公司。目前公司正在中国、美国及澳大利亚开展40多项I/II期临床试验。用于治疗耐药性慢性髓性白血病的核心品种HQP1351已在中国递交新药上市申请,并获纳入优先审评。该品种还获得了美国FDA审评快速通道及孤儿药认证资格。截至目前,公司共有4个在研新药获得11项FDA孤儿药资格认证。
前瞻性声明
本文所作出的前瞻性陈述仅与本文作出该陈述当日的事件或资料有关。除法律规定外,于作出前瞻性陈述当日之后,无论是否出现新资料、未来事件或其他情况,我们并无责任更新或公开修改任何前瞻性陈述及预料之外的事件。请细阅本文,并理解我们的实际未来业绩或表现可能与预期有重大差异。本文内所有陈述乃本文章刊发日期作出,可能因未来发展而出现变动。
相关链接 :