上海2021年3月31日 /新闻稿网 - Xinwengao.com/ — 三生国健药业(上海)股份有限公司(以下简称“三生国健”,688336.SH)今天公布2020年年度报告。三生国健董事长娄竞博士表示:“2020年是三生国健突破进取的一年。面对新冠肺炎疫情的冲击,公司迎难而上砥砺前行,在产品研发、对外合作、公司发展等方面取得了多项进展。作为中国抗体药物的先行者,三生国健紧跟国际步伐,深挖全球创新候选药物,将积极引进创新靶点和联合疗法,形成多梯队、高临床价值与具备核心竞争力的产品结构,打造成为新一代创新抗体生物科技平台。依托19年积淀的抗体药物研发、生产和销售优势,三生国健将积极推动抗体药物的产业化与临床应用,一如既往地努力提高创新抗体药的可及性。实现‘惠及中国,面向全球,为人类健康造福’的企业愿景。”
核心业务取得重大进展
2020年6月19日,三生国健自主研发的注射用伊尼妥单抗(商品名:赛普汀)正式获得国家药品监督管理局(NMPA)批准,获批的首个适应症为和化疗联合用于治疗HER2阳性的转移性乳腺癌。赛普汀是中国第一个Fc段修饰,生产工艺优化,具有更强ADCC效应的创新抗HER2单抗,与化疗药物联合,已被证明可以延缓HER2阳性的转移性乳腺癌患者病情进展,并带来生存获益,为中国HER2阳性转移性乳腺癌患者带来更多选择。赛普汀也是继益赛普和健尼哌之后,三生国健第三款上市销售的单抗产品。
2020年12月底,赛普汀通过了医保谈判,首次被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2020年版)》。作为国产药物中首个针对HER2靶点的抗体药物,其疗效和安全性已得到临床验证。根据中国女医师协会乳腺疾病研究中心发布的《中国进展期乳腺癌共识指南2020(CABC3)》,伊尼妥单抗(赛普汀)成为进展期乳腺癌治疗优选方案之一。根据国卫办医函〔2020〕1047号,伊尼妥单抗已纳入《新型抗肿瘤药物临床应用指导原则(2020年版)》。赛普汀在抢占市场先机方面将有巨大的优势。公司将利用先发优势,迅速渗透市场、扩大患者覆盖,实现未被满足的治疗需求。
研发投入持续加大,提供管线推进“动力引擎”
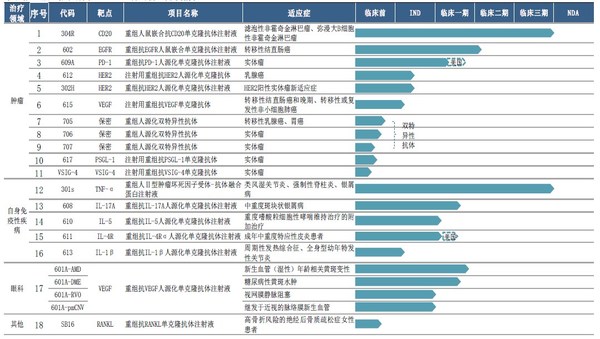
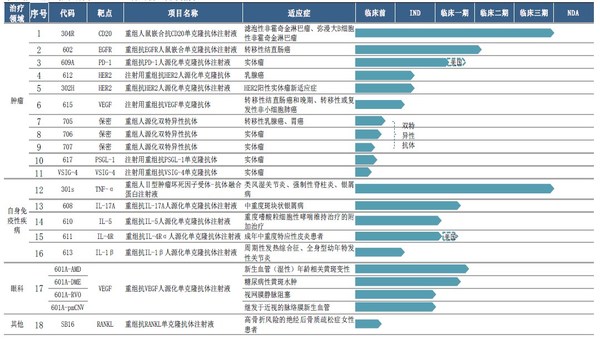
2020年三生国健研发投入总计3.75亿元,较去年同期增加28.48%,占营收比重达57.31%。目前三生国健拥有处于不同开发阶段的18个主要在研抗体药物(包括8个处于临床及临床后阶段的在研药物、10个处于临床前阶段的在研药物),涵盖肿瘤、自身免疫性及眼科等疾病领域,其中大部分在研药物为治疗用生物制品1类或单克隆抗体,部分在研药物为中美双报。截至2020年12月31日,公司共拥有专利权65项,较去年同期新增10项。
三生国健以临床价值为导向,持续加大创新研发投入,多个在研产品取得阶段性成果。2020年共获得3个临床批件,包括抗IL5单抗 610临床试验获NMPA批准,抗IL4Rα单抗611临床试验获NMPA和FDA批准。此外,三生国健还递交了3个在研产品的Pre-IND和IND申请,分别是HER2新抗体(612),IL-1β(613)和注射用重组抗VEGF单克隆抗体(615)。其他在研管线产品研发进展均达到公司预期。
在临床试验进展方面,各重磅靶点在研产品临床试验有序推进:
重组人鼠嵌合抗CD20单克隆抗体注射液(“304R”):已完成与利妥昔单抗在零肿瘤负荷非霍奇金淋巴瘤患者的安全性及药代动力学方面的I期头对头对比临床试验;
重组人II型肿瘤坏死因子受体-抗体融合蛋白注射液(“301S”):已完成现场核查;
重组抗VEGF人源化单克隆抗体注射液(“601A”):完成AMD Ia/Ib入组,准备国际多中心III期方案,2021年H2启动;完成DMEIa/Ib入组;准备II/III期方案;RVO和CNVII期临床准备;
重组抗EGFR人鼠嵌合单克隆抗体注射液(“602”):已完成分别用于健康志愿者及结直肠癌症患者的两项临床I期试验,并已启动该产品用于结直肠癌患者的II期临床试验。患者招募工作正在进行中;
抗IL-17A人源化单克隆抗体(“608”):已完成健康志愿者剂量递增的I期临床试验,将在近期开展用于斑块状银屑病患者II期临床试验;
抗PD-1人源化单克隆抗体注射液(“609A”):中国I期临床试验患者入组完成70%以上,美国I期临床试验完成患者入组;
抗IL-5人源化单克隆抗体注射液(“610”):完成Ia期临床试验入组;
抗白介素4受体alpha(IL-4Rα)的人源化单克隆抗体药物(“611”): 9月获得国家药品监督管理局(NMPA)批准,开展需要系统性治疗的成年中重度特应性皮炎患者的临床试验。此外,该产品在美国临床I期试验近日完成首例受试者入组;
重组抗HER2人源化单克隆抗体注射液(“612”):已提交IND申请;
抗IL-1β人源化单克隆抗体注射液(“613”):已完成临床申报资料撰写,申报Pre-IND;
双特异性抗体(“705”):完成中试生产,开始IND申报资料的撰写工作;
双特异性抗体(“706”):完成中试生产,开始IND申报资料的撰写工作。
未来,公司仍将以开发创新抗体药物为策略方向,继续聚焦自身免疫性疾病、肿瘤、眼科疾病等抗体药物的国际重点疾病领域,以自主研发为主、结合对外合作持续丰富公司在研产品管线。在技术布局方面,未来三至五年,公司将继续聚集新型的下一代生物疗法,同时布局包括免疫检查点、巨噬细胞检查点调节剂、双特异性抗体以及自身综合抗体产品线的联合疗法等前沿领域,加速创新药以及新一代生物疗法的进程,提高前沿生物疗法的可行性,同时公司也在积极推进免疫治疗、靶点治疗等联合用药的治疗方式,用于传统治疗方式无法治疗或治疗效果不佳的疾病。
对外合作多点布局
三生国健一直践行“外部项目引进来、内部项目走出去”的发展策略,通过引进国际领先、国内稀缺且临床需求高的药物,实现技术和产品两个层面的快速跟进和超越。同时,公司也将大力推动自主研发产品的国际注册认证,将加快国际合作步伐作为自身重点发展方向之一。
目前,三生国健与美国Verseau公司在巨噬细胞检查点调节剂抗体领域开展合作。2019至2020年间先后选取PSGL-1靶点的单克隆抗体VTX-0811、VSIG-4靶点的单克隆抗体作为授权产品,由三生国健负责在中国大陆、台湾、香港和澳门的开发和商业化。此外三生国健还与瑞士Numab公司在多特异性抗体领域开展合作,基于Numab的技术平台开发和商业化一系列用于癌症治疗的新型多特异性抗体。
核心业务未来潜力可期
三生国健核心产品益赛普可用于治疗类风湿关节炎、强直性脊柱炎和银屑病,是中国首个上市的全人源抗体类药物,是中国风湿病领域第一个上市的肿瘤坏死因子(TNF-α)抑制剂,填补了国内企业在全人源治疗性抗体类药物的空白,上市以来累计惠及强直性脊柱炎及类风湿关节炎患者数十万人。益赛普已先后获得十几个国家的上市许可。益赛普的国内市场份额自2006年以来一直占据领先地位,虽然随着国内竞争对手的增多,市场竞争日益激烈,但领导地位未被撼动。
益赛普已在国内上市16余年,其药物疗效与安全性在国内市场得到了广泛的临床验证与认可。公司拥有专业的营销团队与完整的销售体系,通过多年对益赛普的学术推广及销售经验的积累与沉淀,在国内终端销售的覆盖方面收获了良好的成果,2020年益赛普覆盖了近3700家医疗机构,其中三级医院覆盖了接近1700家。未来公司将继续在医院覆盖和下沉市场渗透上加大投入,一如既往支持我国风湿科建设与学科教育工作。三生国健还将根据自身国际业务布局规划,继续积极推动益赛普等在内的产品在海外市场的注册上市,促进抗体药物在其他国家的产品渗透率。
2020年对于生物医药行业是非常特殊的一年。我国继续稳步推进有利于创新的药政改革,医保谈判机制的常态化趋势下,高临床价值的优质创新药未来将持续受益。2021年三生国健将积极应对复杂市场环境,紧紧围绕“创新驱动”和“国际布局”两大战略,加快推进研发管线,持续推进国际合作项目,保证产品供应及质量稳定,推动业务稳定发展,加强人才梯队建设,持续完善公司治理。从各个方面,提高管理效率,谋求创新发展。
未来,三生国健将进一步发挥研发、生产、销售、质量管理等多方面的综合竞争优势,积极推动抗体药物储备产品的产业化与临床应用,形成多梯队、高临床价值与具备核心竞争力的产品结构,为包括自身免疫性疾病、肿瘤等患者提供高品质、安全有效的临床解决方案,造福更多患者。
警示说明及前瞻性陈述
本新闻稿包含前瞻性陈述,例如涉及业务和产品前景,或公司的意图、计划、认知、预期及策略。该等前瞻性陈述是根据本公司现有的资料,并按本新闻稿发布时的展望陈述。该等前瞻性陈述基于若干预测、假设及前提,其中一些是主观性的或不受我们控制。该等前瞻性陈述可能被证明是不正确的,或将来可能无法实现。就任何新产品或产品的新适应症, 我们无法确保其将能成功开发或最终上市销售。该等前瞻性陈述受各种风险及不明朗因素影响。我们的其他公开披露文件可能提供该等风险及不明朗因素的更多信息。所涉及之科学信息可能只是初步的和研究性的。本公司股东及潜在投资者在买卖本公司股份时,请务必谨慎行事。