美国旧金山和中国苏州2021年6月21日 /新闻稿网 - Xinwengao.com/ — 信达生物制药(香港联交所股票代码:01801),一家致力于研发、生产和销售用于治疗肿瘤、代谢疾病、自身免疫等重大疾病的创新药物的生物制药公司宣布,达伯舒®(信迪利单抗注射液)联合达攸同® (贝伐珠单抗注射液)用于晚期肝癌一线治疗的随机、对照、开放多中心II/III期关键临床研究(ORIENT-32)结果刊登在国际知名期刊《柳叶刀·肿瘤学》上。
该临床研究由复旦大学附属中山医院樊嘉院士牵头,采用两项国家“重大新药创制”科技重大专项成果联合使用,是全球首个达到主要研究终点的PD-1抑制剂联合治疗用于晚期肝癌一线治疗的III期临床研究发布。
2021年1月,国家药品监督管理局(NMPA)已经受理了达伯舒®(信迪利单抗注射液)联合达攸同®(贝伐珠单抗注射液)治疗一线肝癌患者的新适应症上市申请(sNDA)。
ORIENT-32研究的主要研究者,复旦大学附属中山医院樊嘉教授表示:“这项研究发表在《柳叶刀·肿瘤学》杂志,体现了国际肿瘤学界对这项高质量中国原创研究的认可,在此项研究中,信迪利单抗与贝伐珠单抗的联合治疗提供了全球最大规模的、乙肝相关肝癌患者接受免疫联合治疗和传统靶向治疗的对比数据,给全世界乙肝相关肝癌患者治疗带来新的希望。同时,这也是全体研究团队以及受试者在新冠疫情下,克服重重困难共同付出而实现的成果,为中国乃至全球肝癌患者提供了又一个有效的治疗手段,对于改善肝癌的疗效和预后具有重大意义。”
信达生物制药集团临床开发高级副总裁周辉表示:“全球首个达到主要研究终点的PD-1抑制剂联合治疗晚期肝癌一线的III期临床研究发表在《柳叶刀·肿瘤学》杂志上,对我们而言既是肯定又是激励。希望通过我们的努力,推动这一治疗方法早日上市,惠及更多的肝癌患者及其家庭。达伯舒®和达攸同®均为国家重大新药创制专项成果,信达生物也将继续在医药领域创新实践,响应贯彻‘健康中国2030’战略,践行企业社会责任,为健康事业的可持续发展提供坚实动力。”
关于ORIENT-32研究
研究背景
中国肝细胞癌发病率较高,乙型肝炎病毒(HBV)感染为其主要致病因素。肝细胞癌患者预后较差,目前临床需求仍未得到满足[1]。ORIENT-32是一项2/3期临床研究,旨在评估信迪利单抗(程序性死亡1[PD-1]抑制剂)联合贝伐珠单抗(IBI305)对比索拉非尼用于一线治疗不可切除HBV相关的肝细胞癌。
研究方法
全国共50家临床研究中心参加了这项随机、开放、多中心的2/3期研究。研究入组患者的主要标准为:年龄≥18岁,经组织学或细胞学诊断或临床确认的不可切除或转移性肝细胞癌,且既往未接受过全身系统性治疗的肝细胞癌患者,基线美国东部肿瘤协作组(ECOG)体能状态评分为0或1。
本研究分成2个部分,第1部分是2期单臂安全导入期,患者接受信迪利单抗(200 mg,每3周1次)联合贝伐珠单抗(15 mg/kg,每3周1次)静脉给药。第2部分是3期随机对照研究,符合条件的患者随机(2:1)接受信迪利单抗(200mg,每3周1次)联合IBI305(15mg/kg,每3周1次)静脉给药;或口服索拉非尼(400mg,每日两次),直至出现疾病进展或不可接受的毒性。采用随机分组,并按大血管浸润和/或肝外转移(是vs否)、基线甲胎蛋白(AFP)水平(<400 vs≥400 ng/mL)和ECOG体能状态(0 vs 1)进行分层。3期的主要终点为总生存期和独立影像学审查委员会(IRRC)根据RECIST 1.1标准评估的、在意向性治疗(ITT)人群中的无进展生存期。本研究已在ClinicalTrials.gov中注册,编号为NCT03794440。
研究结果
从2019年2月11日至2020年1月15日,本研究共入组595例患者,其中,2期共24例患者入组且接受治疗,3期共571例患者随机分配至信迪利单抗-贝伐珠单抗组(n=380)或索拉菲尼组(n=191)。在2期研究中22例(92%)发生与任一研究药物相关的不良事件,其中3-4级发生率为29%,与任一研究药物有关的严重不良事件发生率为6例(25%),未发生导致死亡的不良事件。根据2期部分的初步安全性和疗效数据,经安全性评估委员讨论后开始3期研究。
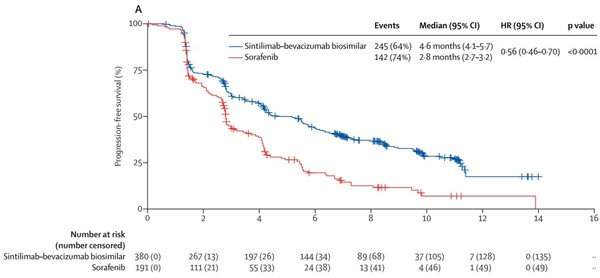
截至数据截止日期(2020年8月15日),信迪利单抗-贝伐珠单抗生物类似药组的中位随访时间为10.0个月(IQR 8.5-11.7),索拉非尼组为10.0个月(IQR 8.4-11.7);与索拉非尼组相比,独立影像学审评委员会(IRRC)评估的信迪利单抗-贝伐珠单抗生物类似药组的无进展生存期也显著改善(中位值4.6个月[95%CI 4.1-5.7] vs.2.8个月[95%CI 2.7-3.2],分层HR 0.56[95%CI 0.46-0.70],p<0.0001)。
在总生存期的首次期中分析中,与索拉非尼相比,信迪利单抗-贝伐珠单抗生物类似药的总生存期也显著改善(中位值未达[95%CI 未达–未达] vs 10.4个月[94%CI 8.5-未达],HR 0.57 [95%CI 0.43-0.75],p<0.0001)。
最常见的3-4级治疗期间的不良事件为高血压(信迪利单抗-贝伐珠单抗生物类似药组380例患者中55例[14%]vs索拉非尼组191例患者中11例[6%])和掌跖红肿疼痛综合征(无vs 22例[12%])。信迪利单抗-贝伐珠单抗生物类似药组123例(32%)患者和索拉非尼组36例(19%)患者发生严重不良事件,两组与任一研究药物相关的导致死亡的不良事件发生率分别为6例(2%)和2例(1%)。
研究结论
信迪利单抗-贝伐珠单抗生物类似药在一线治疗不可切除的HBV相关肝细胞癌中国患者中显示出显著的总生存期和无进展生存期获益,具有可接受的安全性特征。这个联合用药方案为该类患者提供了一种新的治疗选择。
参考文献
原文链接:
https://www.thelancet.com/journals/lanonc/article/PIIS1470-2045(21)00252-7/fulltext
关于肝癌
肝癌是全世界范围内常见的消化系统恶性肿瘤,中国的肝癌患者占全球数量的一半左右,肝癌严重地威胁着我国人民的生命和健康。肝癌的病理类型主要是肝细胞癌(hepatocellular carcinoma,HCC),占85%~90%;还有少数为肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)和HCC-ICC 混合型等。在我国,HCC主要由乙型肝炎病毒(hepatitis B virus,HBV)和/或丙型肝炎病毒(hepatitis C virus,HCV)感染引起。
关于信迪利单抗
信迪利单抗,中国品牌名为达伯舒®(信迪利单抗注射液),是信达生物制药和礼来制药共同合作研发的具有国际品质的创新PD-1抑制剂药物。信迪利单抗是一种人类免疫球蛋白G4(IgG4)单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的 PD-1/程序性死亡受体配体1(Programmed Death-Ligand 1, PD-L1)通路,重新激活淋巴细胞的抗肿瘤活性,从而达到治疗肿瘤的目的。目前有超过二十多个临床研究(其中10多项是注册临床试验)正在进行,以评估信迪利单抗在各类实体肿瘤和血液肿瘤上的抗肿瘤作用。信达生物同时正在全球开展信迪利单抗注射液的临床研究工作。
信迪利单抗已在中国获批三项适应症,包括:
- 用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤
- 联合培美曲塞和铂类化疗用于EGFR或ALK阴性的晚期非鳞状NSCLC的一线治疗
- 联合吉西他滨和铂类化疗适用于不可手术切除的局部晚期或转移性鳞状NSCLC的一线治疗
信迪利单抗另有两项上市申请已获中国药品监督管理局受理审评,包括:
- 联合达攸同®(贝伐珠单抗注射液)用于肝细胞癌的一线治疗
- 用于鳞状NSCLC的二线治疗
2021年5月,信迪利单抗联合培美曲塞和铂类用于非鳞状NSCLC一线治疗的上市申请已获美国FDA正式受理审评。
信迪利单抗已于2019年11月成功进入中国国家医保目录,成为全国首个,也是当年唯一一个进入国家医保目录的PD-1抑制剂。
关于达攸同®(贝伐珠单抗注射液)
达攸同®为贝伐珠单抗注射液生物类似药,又名重组抗VEGF人源化单克隆抗体注射液。VEGF是一种血管生成过程中重要的因子,在多数人类肿瘤内皮细胞中过度病理表达。抗VEGF抗体,可以高亲和力地选择性结合VEGF,通过阻断VEGF与其血管内皮细胞表面上的受体结合,阻断PI3K-Akt/PKB和Ras-Raf-MEK-ERK等信号通路的传导,从而抑制血管内皮细胞的生长、增殖、迁移以及血管新生,降低血管渗透性,阻断肿瘤组织的血液供应,抑制肿瘤细胞的增殖和转移,诱导肿瘤细胞凋亡,从而达到抗肿瘤的治疗效果。原研药贝伐珠单抗注射液自上市以来,全球已获批其用于治疗包括非小细胞肺癌、转移性结直肠癌、胶质母细胞瘤、肾细胞癌、宫颈癌、卵巢癌、输卵管癌、腹膜癌等多个实体瘤,其显著的疗效和良好的安全性已得到普遍认可。在中国,达攸同已获批包括晚期非小细胞肺癌、转移性结直肠癌、成人复发性胶质母细胞瘤和肝细胞癌治疗四项适应症。
关于信达生物
“始于信,达于行”,开发出老百姓用得起的高质量生物药,是信达生物的理想和目标。信达生物成立于2011年,致力于开发、生产和销售用于治疗肿瘤、自身免疫、代谢疾病等重大疾病的创新药物。2018年10月31日,信达生物制药在香港联合交易所有限公司主板上市,股票代码:01801。
自成立以来,公司凭借创新成果和国际化的运营模式在众多生物制药公司中脱颖而出。建立起了一条包括24个新药品种的产品链,覆盖肿瘤、代谢疾病、自身免疫等多个疾病领域,其中6个品种入选国家“重大新药创制”专项。公司已有 4个产品(信迪利单抗注射液,商品名:达伯舒®,英文商标:TYVYT®;贝伐珠单抗生物类似药,商品名:达攸同®,英文商标:BYVASDA ®;阿达木单抗生物类似药,商品名:苏立信®,英文商标:SULINNO ®;利妥昔单抗生物类似药,商品名:达伯华®,英文商标:HALPRYZA®)获得NMPA批准上市,其中信迪利单抗在美国的上市申请(BLA)获FDA受理,6个品种进入III期或关键性临床研究,另外还有14个产品已进入临床研究。信迪利单抗已于2019年11月成功进入国家医保目录,成为全国首个,也是当年唯一一个进入国家医保目录的PD-1抑制剂。
信达生物已组建了一支具有国际先进水平的高端生物药开发、产业化人才团队,包括众多海归专家,并与美国礼来制药、Adimab、Incyte、MD Anderson 癌症中心和韩国Hanmi等国际合作方达成战略合作。信达生物希望和大家一起努力,提高中国生物制药产业的发展水平,以满足百姓用药可及性和人民对生命健康美好愿望的追求。详情请访问公司网站:www.innoventbio.com。
前瞻性声明
本新闻稿所发布的信息中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用“预期”、“相信”、“预测”、“期望”、“打算”及其他类似词语进行表述时,凡与本公司有关的,目的均是要指明其属前瞻性表述。本公司并无义务不断地更新这些预测性陈述。
这些前瞻性表述乃基于本公司管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些乃超出本公司的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。
[1]1. Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015; CA Cancer J Clin 2016; 66: 115-32.2. Xie DY, Ren ZG, Zhou J, Fan J, Gao Q. 2019 Chinese clinical guidelines for the management of hepatocellular carcinoma: updates and insights. Hepatobiliary Surg Nutr. 2020 Aug;9(4):452-463. doi: 10.21037/hbsn-20-480. [2][3]Reprinted from The Lancet, https://doi.org/10.1016/S1470-2045(21)00252-7, Prof Zhenggang Ren, MD, Prof Jianming Xu, MD, Prof Yuxian Bai, MD, Prof Aibing Xu, MD, Prof Shundong Cang, MD, Prof Chengyou Du, MD, et al., Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2–3 study, Copyright (2021), with permission from Elsevier
相关链接 :
http://www.innoventbio.com
![图A:独立影像基于RECIST V1.1评估的PFS Kaplan–Meier曲线图[2] 图A:独立影像基于RECIST V1.1评估的PFS Kaplan–Meier曲线图[2]](https://www.xinwengao.com/cn/wp-content/uploads/image_1-1347.jpg)