上海2021年8月25日 /新闻稿网 - Xinwengao.com/ — 8月26日,中国抗体药物先行者三生国健(证券代码:688336)公布2021年半年度报告。截止2021年6月30日,公司实现营业收入4.79亿元,同比增长36.33%;归属于上市公司股东的净利润2242.31万元,归属于母公司所有者的扣除非经常性损益的净利润695.39万元,均实现同比扭亏为盈。
2021年上半年,公司核心产品益赛普的以价换量、渠道下沉策略取得良好成果,销量较去年同期成倍增长;赛普汀在纳入医保后积极推进进院工作,于4月被正式纳入CSCO乳腺癌诊疗指南,并继续开展多项临床试验。研发上,公司持续加大创新研发投入,上半年研发费用2.14亿元,同比增长30.45%。同时加快临床步伐,取得多项重要进展。此外,公司还积极履行社会责任,“强直性脊柱炎健康乡村工程”取得显著成效,为更多患者带去了福音。
紧跟时代脉搏 重拾增长趋势
随着国家生物医药产业政策的不断出台,大力发展创新药物已经成为生物医药行业发展的必然趋势。一方面,创新药审批制度正在逐步与国际接轨,大大加快了我国创新药的上市速度。另一方面,以医保谈判为标志的一系列改革措施也在倒逼生物医药企业向真正的高水平创新转型,对企业的综合实力提出更高要求。
在风湿免疫领域,近年来我国不断加大对于风湿免疫疾病的诊疗力度,鼓励风湿科建设,国内风湿疾病的治疗率正在不断提升。为了更好地提高TNF-α抑制剂的可及性,提升风湿免疫药物的渗透率和覆盖面,益赛普于2020年底主动调整价格,并做好对县域市场的渠道下沉,取得了良好的效果。
2021年上半年,益赛普共销售约154万支(折合25mg),同比增长153.15%,实现销售收入4.28亿元,同比增长29.54%。作为一款已经上市16年的产品,益赛普与国内同类产品相比,其药物疗效与安全性在国内市场得到了更加广泛的临床验证与认可,在临床运用中已具备较强的品牌效应。除此之外,公司专业的营销团队与完整的销售体系也是益赛普销量增长的重要原因。
2020年6月,由公司自主研发的我国首个国产抗HER2单抗赛普汀(注射用伊尼妥单抗)正式获得国家药品监督管理局(NMPA)批准上市,并于同年成功进入国家医保目录。2021年上半年,赛普汀再迎重要里程碑。在4月召开的中国临床肿瘤学会指南会上(CSCO),赛普汀被纳入《2021 CSCO乳腺癌诊疗指南》,成为晚期乳腺癌患者全程抗HER2治疗的基础药物。
此外,公司今年还逐步加大了CD25人源化单抗健尼哌在临床应用方面的学术推广,满足相关患者的临床用药需求,推进对全国各地医院的销售覆盖。2021年上半年,新冠疫情影响减弱,全国肾移植手术量逐步恢复,带动健尼哌的销售大幅增长。报告期内,健尼哌销售收入同比增长198.07%。
研发硕果累累 蓄力发展动能
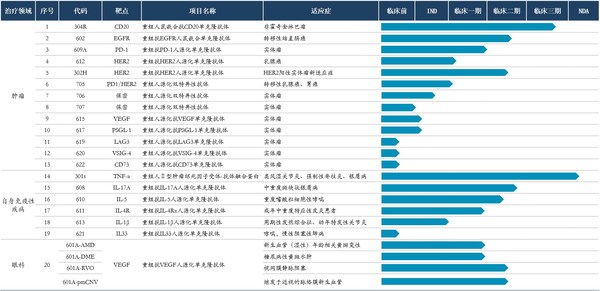
上半年,公司继续深耕自身免疫疾病、肿瘤、眼科等热门疾病领域,以临床价值为导向,持续加大创新研发投入,多个创新产品取得阶段性成果,研发管线得到进一步充实,为未来发展奠定良好的基础。
- 新获得临床批件3项:
(1) 抗HER2抗体(612)获NMPA批准开展用于晚期实体瘤治疗的临床研究
(2) 抗EGFR抗体(602)获NMPA批准开展联合伊尼妥单抗及化疗在HER2 阳性且KRAS、NRAS 和BRAF 野生型的转移性结直肠癌患者中有效性和安全性的Ib/Ⅱ期临床研究
(3) 抗HER2 x 抗PD1双特异抗体(705)获FDA批准开展治疗晚期或转移性 HER2 表达阳性的实体瘤的临床研究
- 新递交IND申请4项:
(1) 重组人源化抗IL-1β抗体(613)治疗周期性发热综合征(NMPA)
(2) 重组人源化抗IL-1β抗体(613)治疗全身性幼年特发性关节炎(NMPA)
(3) 重组人源化双特异抗体(705)治疗实体瘤(NMPA)
(4) 伊尼妥单抗联合抗CD47融合蛋白IMM01 治疗HER2阳性实体瘤(NMPA)
- 新增Pre-IND 申请1项:
(1) 重组人源化双特异抗体(706)治疗实体瘤(NMPA)
- 新增抗体立项3项:
(1) 重组人源化抗LAG-3单克隆抗体(619)
(2) 重组人源化抗 IL-33 抗体(621)
(3) 重组人源化抗CD73抗体(622)
管线内其他产品的研发进展也有序推进。
- 重组人鼠嵌合抗CD20单克隆抗体注射液(304R)是公司自主研发的针对非霍奇金淋巴瘤治疗的抗体药物,2021年至今已完成 III期临床试验核查
- 重组人II型肿瘤坏死因子受体-抗体融合蛋白注射液(301S)是益赛普的新剂型,也是相关药品国内首个预充式剂型,2021年至今已重新递交 NDA申请
- 重组抗VEGF人源化单克隆抗体注射液(601A)2021年至今已完成AMD和DME I/Ib期临床试验;BRVO II期临床试验入组完成;CRVO II期临床试验病人入组顺利;CNV II期临床试验开始入组
- 重组抗EGFR人鼠嵌合单克隆抗体注射液(602)是公司自主研发的针对转移性结直肠癌治疗的抗体药物,2021年至今II期临床试验入组率已达50%
- 抗IL-17A人源化单克隆抗体(608)是公司自主研发的治疗斑块状银屑病药物,2021年至今已完成I期临床试验,II期临床试验开始入组
- 抗PD-1人源化单克隆抗体注射液(609A)2021年至今已完成在中国的I期临床试验,并递交联合用药治疗多种实体瘤II/III期临床IND
- 抗IL-5人源化单克隆抗体注射液(610)针对18岁及以上重度嗜酸性粒细胞性哮喘维持治疗的附加治疗,2021年至今已完成Ia期临床试验,启动Ib+II期临床试验
- 抗IL-4Rα人源化单克隆抗体药物(611)针对中重度特应性皮炎及哮喘的治疗,2021年至今已在美国完成I期临床试验,正在进行数据锁库分析,并在中国启动Ib/II期试验入组
国际化布局方面,公司也以“外部项目引进来、内部项目走出去”为基本原则,努力引进国际领先、国内稀缺且临床需求高的药物。同时,积极推动已上市产品在海外市场的注册上市,对自主研发创新品种积极开展国际临床试验,寻求自主研发品种与国际合作的机会。目前,公司正与美国Verseau公司在巨噬细胞检查点调节剂抗体领域开展合作,在肿瘤免疫治疗领域选取PSGL-1靶点的单克隆抗体VTX-0811、VSIG-4靶点的单克隆抗体作为授权产品;与瑞士Numab公司在多特异性抗体领域开展合作,基于Numab的技术平台开发和商业化一系列用于癌症治疗的新型多特异性抗体。
未来,公司将继续以开发创新抗体药物为方向,采取灵活多样的创新手段,以自主研发为主、结合对外合作,持续推动技术创新与产学研相结合,布局包括免疫检查点、巨噬细胞检查点调节剂、双特异性抗体等创新技术,加速创新药以及新一代生物疗法的进程。同时,公司也在积极推进免疫治疗、靶点治疗等联合用药的治疗方式,用于传统治疗方式无法治疗或治疗效果不佳的疾病。
赋能基层医疗 用心回馈社会
自2019年起,三生国健便积极参与并支持“强直性脊柱炎健康乡村工程”,帮助广大基层强直患者接受治疗,经过近两年的努力,项目成效显著。截止6月底,项目已在全国21个省出台项目实施方案并落地执行,累计开展培训和义诊活动349场,培训定点医院项目相关医务人员5275人,完成患者初筛10004人,实际救治2173名建档立卡的中重度贫困强直患者,在改善患者健康水平,减轻患者家庭负担的同时,推动风湿免疫疾病在基层医疗体系的治疗水平不断提高,获得了受助群众、定点医院和地方政府的高度认可。
三生国健董事长娄竞博士表示:“2021年上半年,三生国健积极应对市场变化,核心产品取得较快增长,净利润实现扭亏为盈。更重要的是,我们在扭亏的同时保持了高水平的研发投入,临床步伐明显加快,管线中的多个创新药物取得重要研发进展,为公司的长期发展保留了强劲的动能。随着医疗改革持续深入,对生物药企综合实力的要求也在不断提高,尤其是对企业的创新提出了更高的挑战。无创新则无未来,三生国健将保持创新的战略不变,进一步巩固公司自身免疫疾病领域的商业化优势,积极推进自免、肿瘤、眼科领域的新药研发进程。我们将继续秉承‘珍爱生命、关注生存、创造生活’的理念,不断强化公司核心竞争力,践行‘让创新抗体药触手可及’的使命,推动更多优质的创新药早日上市,造福更多患者。”