|
济南2023年12月8日 /新闻稿网 - Xinwengao.com/ — 12月6-8日,欧洲肿瘤内科学会免疫肿瘤学(ESMO Immuno-Oncology)大会在瑞士日内瓦召开,齐鲁制药以壁报形式报告了QLS31905在晚期实体瘤患者中的I期临床试验最新研究结果(壁报编号:132P)。主要研究者为北京大学肿瘤医院的沈琳教授。
QLS31905是由齐鲁制药自主研发的靶向Claudin18.2的双特异性T细胞衔接器(Bispeific T cell Engager)。本研究的主要目的是探索QLS31905在晚期实体瘤患者中安全性、耐受性,以及初步的抗肿瘤活性。
研究背景和设计:
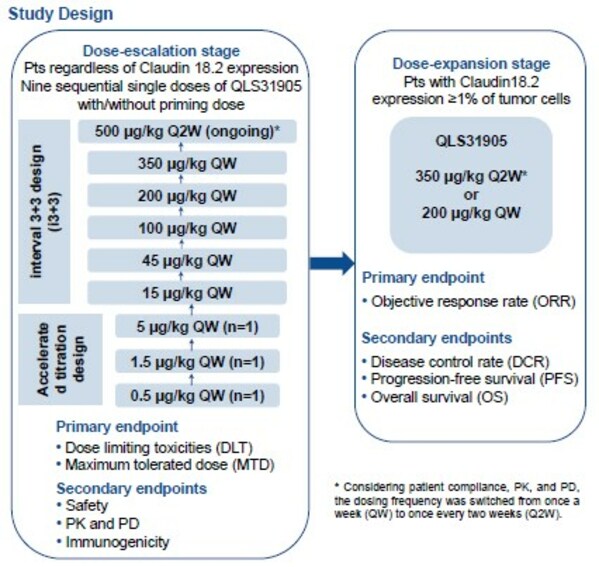
Claudin18.2是具有高度特异性的细胞表面分子,其异常激活表达常见于原发性胃癌以及胰腺癌、食管癌等实体瘤[1],[2]。QLS31905与肿瘤细胞表面的Claudin18.2和T细胞表面的CD3结合,通过募集和激活肿瘤细胞附近的T细胞,对肿瘤细胞进行持续地杀伤裂解。本研究纳入标准治疗失败或不适用或无标准治疗的晚期实体瘤患者。研究分为剂量递增和剂量拓展两个阶段。剂量递增阶段采用加速滴定和i3+3的研究设计,QLS31905单次给药剂量按照0.5μg/kg QW、1.5μg/kg QW、5μg/kg QW、15μg/kg QW、45μg/kg QW、100μg/kg QW、200μg/kg QW、350μg/kg QW、500 μg/kg Q2W递增,主要终点是剂量限制毒性(DLT)和最大耐受剂量(MTD),次要终点是安全性、药代动力学和药效动力学、免疫原性。剂量拓展阶段的主要终点是客观缓解率(ORR),次要终点是疾病控制率(DCR)、无进展生存期(PFS)、总体生存期(OS)。
研究结果:
截止2023年7月17日,共计纳入52例受试者,包括31例胃癌和12例胰腺癌患者。剂量递增阶段,共计22例受试者从0.5μg/kg QW爬坡到350 μg/kg QW队列,目前500 μg/kg Q2W剂量水平正在进行中。剂量拓展阶段采用了200μg/kg QW和350μg/kg Q2W两个剂量水平,共计纳入30例受试者。
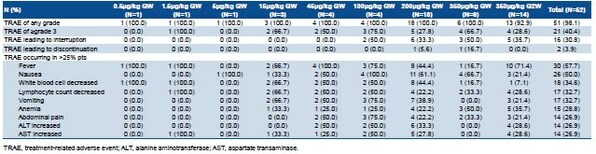
安全性方面,DLT未发生,尚未确定MTD。共计21例(40.4%)受试者发生了≥3级的治疗相关不良事件(TRAE)。10例(19.2%)受试者发生了治疗相关的严重不良事件。2例受试者(3.8%)发生了导致停止治疗的TRAE。最常见的TRAE是发热(30例,57.7%)、恶心(26例,50.0%)、白细胞计数降低(18例,34.6%)。350 μg/kg QW队列中的2例患者发生3级及以上的细胞因子释放综合征。
疗效方面,在疗效可评价的27例受试者中,ORR为11.1%,DCR为63.0%。达到部分缓解(PR)的3例患者中,2例为胰腺癌,1例为胆囊癌,Claudin18.2表达水平均为中/高表达。在14例疾病稳定(SD)的患者中,8例靶病灶缩小,其中7例为Claudin18.2中/高表达。
综上,QLS31905在晚期实体瘤患者中展现出良好的安全性、耐受性、以及初步的抗肿瘤活性。目前QLS31905的II期临床试验正在进行中。
【参考文献】
|
1. Sahin U, et al. Clin Cancer Res. 2008;14(23):7624-34. |
|
2. Singh P, et al. J Hematol Oncol. 2017;10(1):105. |